La
struttura delle proteine
AMMINOACIDI
STRUTTURA PRIMARIA
STRUTTURA
SECONDARIA
STRUTTURA TERZIARIA
STRUTTURA
QUATERNARIA
ENZIMI
In questa pagina
illustrerò molto brevemente e sinteticamente la struttura
delle proteine e degli enzimi. Cercherò di non essere molto
lungo e dispersivo, anche se l'argomento richiederebbe una trattazione
ben più vasta di questa. Chi ha già studiato un
minimo di biochimica strutturale (chimica biorganica, biochimica, ecc.)
può benissimo evitare di leggere questa parte, dedicata ai
totalmente profani della materia.
Direi di partire dalle
basi strutturali delle proteine, ossia dagli amminoacidi:
Gli
amminoacidi
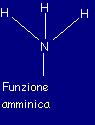
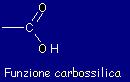
Gli amminoacidi sono
piccole molecole di natura organica chiamate così per il
fatto di avere all'interno una funzione amminica (ossia una funzione
con l'azoto N) e una parte costituita da un acido carbossilico:
Nel complesso, un
generico amminoacido ha una struttura formata dalle due funzioni legate
al centro da un carbonio detto carbonio
α, a cui è legata una catena
laterale di natura variabile (qui rappresentata genericamente con R) di
cui parleremo in seguito:
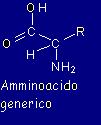
Potete notare la funzione
carbossilica sulla sinistra in alto e la funzione amminica sulla destra
in basso, legate dal carbonio alfa al centro, da cui parte la catena R.
La quasi
totalità delle proteine conosciute è costituita
essenzialmente da una sequenza di 20 amminoacidi diversi. Questi si
differenziano tra loro esclusivamente in base alla catena laterale R.
Esistono quindi amminoacidi idrofobici (con catena R idorofobica o
apolare, non solubili in acqua), polari (con catena R polare, solubili
in acqua), acidi (con catena R acida),
basici (con catena R basica) ecc.
Nelle
seguenti tabelle
sono riportati i 20 amminoiacidi, divisi in base alle loro
caratteristiche principali. Oltre al nome e ai 2 simboli, a 3 e ad 1
lettera, sono riportate anche le strutture delle catene laterali che
caratterizzano l'amminoacido (per risalire ala struttura originaria,
basta sostituire quella catena ad R nella struttura generica
dell'aminoacido).
Amminoacidi
apolari o idrofobici
| Glicina |
Gly |
(G) |
 |
| Alanina |
Ala |
(A) |
 |
| Valina |
Val |
(V) |
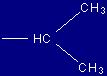 |
| Leucina |
Leu |
(L) |
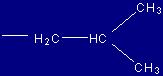 |
| Isoleucina |
Ile |
(I) |
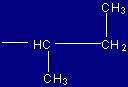 |
| Metionina |
Met |
(M) |
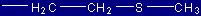 |
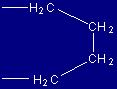
| Prolina |
Pro |
(P) |
 |
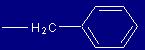
| Fenilalanina |
Phe |
(F) |
 |
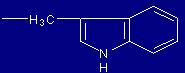
| Triptofano |
Trp |
(W) |
 |
Amminoacidi polari non
carichi
| Serina |
Ser |
(S) |
 |
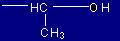
| Treonina |
Thr |
(T) |
 |
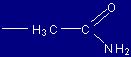
| Asparagina |
Asn |
(N) |
 |
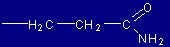
| Glutammina |
Gln |
(Q) |
 |
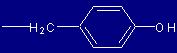
| Tirosina |
Tyr |
(Y) |
 |
| Cisteina |
Cys |
(C) |
 |
Amminoacidi polari basici
| Lisina |
Lys |
(K) |
 |
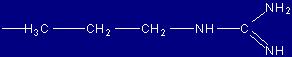
| Arginina |
Arg |
(R) |
 |
| Istidina |
His |
(H) |
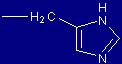 |
Amminoacidi polari acidi
| Aspartato |
Asp |
(D) |
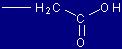 |
| Glutammato |
Glu |
(E) |
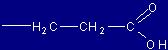 |
Tabella riassuntiva dei
20 amminoacidi
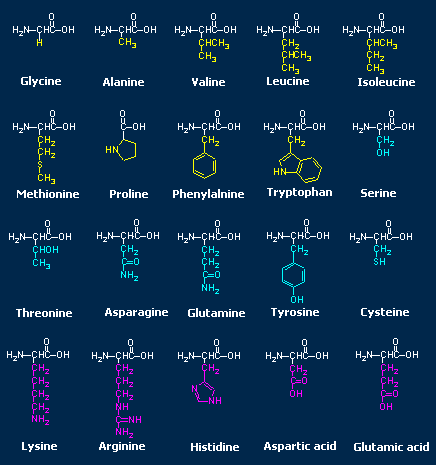
Quello che rende le
proteine delle lunghe catene di amminoacidi è il fatto che
essi possono legarsi tra loro mediante un legame peptidico
tra la funzione carbossilica di uno e la funzione amminica del
successivo. Nella figura, ad esempio, è mostrato una piccola
sequena di 3 amminoacidi, la glicina, la treonina e l'istidina; notate
come le catene laterali non svolgono nessuna funzione in questo legame:
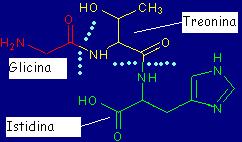
La glicina è
colorata in rosso, la treonina in giallo e l'isitidina in verde. I
pallini stanno ad indicare i 2 legami peptidici che formano
la sequenza.
Una sequenza di
amminoacidi è detta peptide
o polipeptide.
Le proteine sono anche chiamate in questi due modi.
Le quattro strutture delle
proteine
Le
proteine sono formate, abbiamo detto, da una catena più o
meno lunga di amminoacidi, tenuti assieme da legami peptidici. Per struttura
primaria di una proteina si intende la sequenza lineare
degli amminoacidi, dall'inizio alla fine della proteina. Questa
struttura è importantissima in quanto è univoca
per ogni proteina: proteine diverse hanno una sequenza diversa di
amminoacidi e, quindi, struttura diversa.
Il concetto fondamentale da comprendere è che la funzione di
una proteina, il suo meccanismo di funzionamento, è
strettamente legato alla sua struttura tridimensionale e questa, a sua
volta, è univoca per ogni proteina ed è
determinata da un'altrettanto univoca sequenza amminoacidica.
Ricapitolando, ogni proteina si distingue da tutte le altre per la sua
sequenza di amminoacidi, che permette alla proteina di avere una ed una
sola struttura tridimensionale; di conseguenza la proteina
potrà svolgere al meglio la sua unica funzione.
La struttura secondaria
riguarda regioni diverse della sequenza. Senza scendere più
di tanto nei dettagli, è sufficiente tener presente che il
legame peptidico è fisso e immobile su un piano mentre gli
amminoacidi sono liberi di muoversi utilizzando i carboni alfa come
perni di movimento:
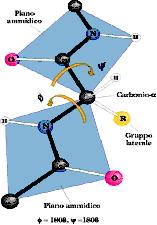
Questo fa
sì che una lunga serie di amminoacidi possa riarrangiarsi
tridimensionalmente in strutture particolari, dette appunto, strutture
secondarie. Le più diffuse sono 2: le eliche e i
foglietti. Le prime sono eliche destrorse, con le catene laterali che
sporgono all'esterno e sono liberi di interagire con determinate
strutture appartenenti o meno alla proteina stessa:
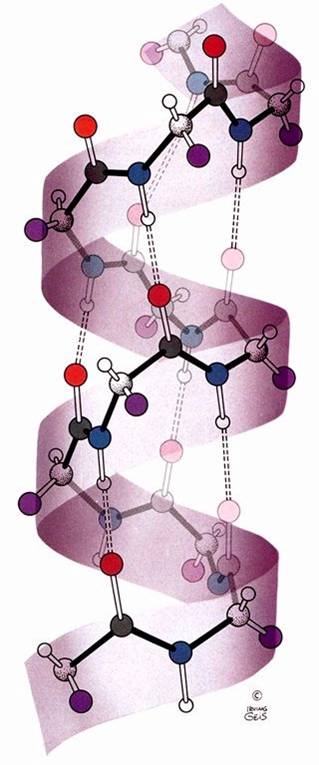
I
foglietti, invece, sono formati da 2 o più file di
amminoacidi che si dispongono parallelamente tra loro, con un andamento
parallelo o anti-parallelo:
I
foglietti vengono rappresentati come strisce orientate da una freccia.
Quello
che determina l'insieme delle eliche, dei foglietti e delle zone di
proteina non ripiegate in struttura secondaria, è la struttura
terziaria, ossia la vera e propria forma tridimensionale
di una proteina. Bisogna ricordare che se una proteina si ripiega in
una determinata maniera a dare una ben precisa struttura terziaria,
è perchè le eliche e i foglietti si sono formati
nei posti giusti, in modo da permettere determinate interazioni tra le
diverse zone della proteina; capita spesso, infatti, che amminoacidi
molto distanti tra loro nella sequenza lineare si trovino a pochissima
distanza tra loro. I foglietti e le eliche, però, si possono
formare solo in presenza di determinati amminoacidi nei posti giusti:
se un'elica (o un foglietto) si forma è perchè
c'è una determinata sequenza di amminoacidi che, ripiegata
ad elica (o a foglietto), trova la sua conformazione ideale. Se non ci
fosse questa sequenza, l'elica, o il foglietto, non si formerebbe, e
non potrebbe neanche formarsi la struttura terziaria corretta; ecco
perchè la struttura primaria è fondamentale ed
è univoca per ogni proteina:
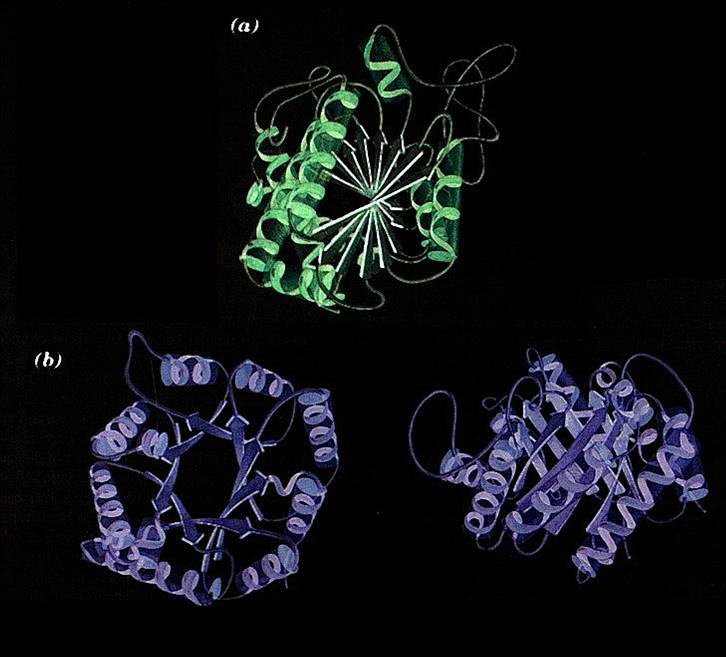
Una
catena polipeptidica può non bastare a caratterizzare una
proteina che, quindi, può risultare formata da
più catene, dette, in questo caso, subunità.
Le varie subunità si associano tra loro con interazioni
deboli ma non
con legami chimici covalenti.
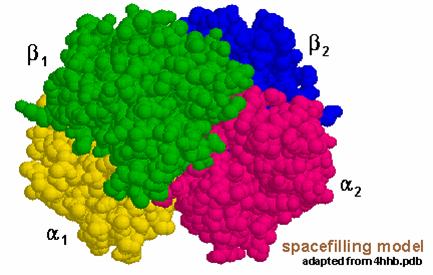
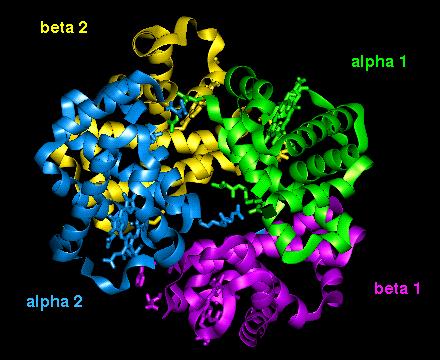
La struttura quaternaria
è quella data dall'associazione delle diverse
subunità a formare la proteina matura. In queste due
immagini è rappresentata la proteina di trasporto
emoglobina, che trasporta ossigeno nel sangue; sono messe in evidenza
le 4 diverse subunità:
Gli enzimi
Gli
enzimi rappresentano una vastissima classe di molecole di natura
proteica (anche se esistono alcuni enzimi non proteici, ma che non ci
interessano). Essi vengono comunemente definiti come "catalizzatori
biologici". Per poter comprendere questa definizione credo sia
necessario dare una spiegazione di catalizzatore.
Una qualsiasi reazione chimica ha una sua equazione cinetica, ossia ha
una sua velocità intrinseca. Se, per ragioni che non
tratteremo di natura termodinamica, una reazione è favorita,
allora essa decorrerà spontaneamente da reagenti a prodotti con una certa
velocità, espressa in termini di aumento di
quantità di prodotti (o diminuzione di quantità
di reagenti) nell'unità di tempo. Esistono reazioni favorite
ma lentissime, come il passaggio del diamante a grafite, e reazioni
velocissime, dell'ordine dei femto-secondi (10-12 secondi).
Ogni
reazione ha, tuttavia, un certo "equilibrio dinamico", nel senso che i
reagenti tendono a essere convertiti in prodotti con una certa
velocità x e i prodotti tendono a ritornare reagenti con una
certa altra velocità y; se la velocità x è
maggiore della velocità y, allora è favorita la
formazione di prodotti (favorita la reazione diretta) mentre se y
è maggiore di x, allora è favorita la formazione di
reagenti (favorita la reazione inversa).
Un catalizzatore biologico velocizza la reazione in analisi; bisogna sottolineare che esso velocizza la reazione in entrambi i sensi,
ma non favorisce nessuna delle 2. In altre parole, non rendono favorita
una reazione non favorita (o almeno, non direttamente. E' sufficiente
sapere che, dove gli enzimi agiscono su reazioni sfavorite dal punto di
vista energetico, lo fanno perchè, contemporaneamente, stanno
sottraendo energia da qualche altra reazione).
Esistono tantissimi tipi di catalizzatori, sia di natura inorganica,
che organica, che biologica (gli enzimi, apppunto). Gli enzimi sono di
gran lunga i più utilizzati, in quanto sono molto più
specifici e lavorano a condizioni molto più blande. I
catalizzatori inorganici, in genere, per funzionare, richiedono
condizioni limite, come pH molto acidi o basici, temperature
elevatissime, pressioni molto alte, ecc. Si intuisce molto facilmente
che è difficile riprodurre queste condizioni all'interno di una
cellula. Gli enzimi, invece, lavorano in genere a pH attorno a 6-7, a
temperatura attorno ai 37 °C e ad 1 atmosfera di pressione, tutte
condizioni, cioè, a valori fisiologici.
La specificità degli enzimi è l'oggetto di interesse di
questa sezione. Esiste un numero enorme di enzimi, divisi in 6 classi
maggiori, in base alla loro attività principale; ogni classe
è poi suddivisa in sottoclassi a seconda del tipo di molecola o
struttura su cui agiscono.
In ambito biologico, in genere, è rispettata la corrispondenza
"1 reazione = 1 enzima". In altre parole, ogni data reazione, con
determinati reagenti e che deve dare determinati prodotti, a
determintate condizioni, in un momento determinato, ha uno e un solo
enzima. In realtà esistono enzimi in grado di fare più di
una reazione; molti, ad esempio, sono in grado di catalizzare
(=velocizzare) anche la reazione inversa (ad esempio, la malato deidrogenasi catalizza sia l'ossidazione di malato ad ossalacetato sia la riduzione di ossalacetato a malato).
Data l'enorme quantità di reazioni biochimiche che avvengono
all'interno della cellula, è facile intuire come esistano
tantissimi enzimi diversi tra loro. Essi catalizzano ogni tipo di
reazione: ossidoriduzioni, reazioni acido-base, trasferimenti di gruppi
chimici da una molecola all'altra o in punti diversi della stessa
molecola, ecc.
Ogni enzima, quindi, è specifico per il suo substrato,
ossia il reagente della reazione: ad esempio, la fosfo-frutto-chinasi
(PFK) è specifica esclusivamente per il fruttosio-6-fosfato e
catalizza la sua conversione a fruttosio-bifosfato mentre non si lega
assolutamente ad un'altra molecola, magari anche molto simile, come il
glucosio-6-fosfato. Un altro esempio è dato dalle polimerasi; la DNA polimerasi
è la molecola che duplica il DNA nella cellula quando essa deve
dividersi e deve dare alla cellula figlia un corredo genetico
completo. L'enzima legge lo stampo da copiare e prende i "mattoncini"
di DNA per legarli uno all'altro ma se per caso, invece di prendere un
mattoncino di DNA, la DNA polimerasi prende un mattoncino di RNA, molto
simile, differente solo per un gruppo OH (praticamente c'è un O
in più, quindi un solo atomo di differenza), tutto il processo
si blocca e si cerca di riparare.
Ma cosa conferisce ad un enzima questa sua estrema e sorprendente
specificità per il suo substrato e lo rende inabile a legare
qualunque altro substrato? La risposta è nel fatto che gli
enzimi sono (praticamente sempre) delle proteine e anche per loro
valgono tutte le considerazioni fatte sopra; ognuno di loro ha una
precisa struttura primaria, univoca, che conferisce loro una specifica
struttura secondaria e una e una sola struttura terziaria. Il concetto
della stretta relazione tra struttura e funzione è qui portato
al massimo della sua espressione: un enzima funziona, e quindi è
in grado di legarsi al suo substrato, se e solo se è ripiegato
correttamente.
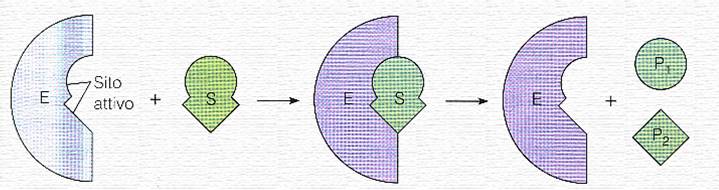
Il substrato non si lega a caso sull'enzima ma in un punto ben determinato, detto sito catalitico o sito attivo,
in cui l'enzima fa convergere tutti i reagenti e in cui avviene la
reazione; i prodotti hanno una struttura tridimensionale ben diversa da
quella dei reagenti e, quindi, non possono più rimanere legati al sito
catalitico dell'enzima (si dice che perdono affinità
per l'enzima) e, di conseguenza, escono. Si deve pensare al complesso
enzima-substrato come un "gioco ad incastro" in cui il substrato ha una
struttura tridimensionale esattamente complementare a quella del sito
catalitico:
Si osservi, ad esempio, il cambiamento di struttura dell'enzima esochinasi che si chiude come una tenaglia quando è legato al suo substrato, ossia il glucosio:
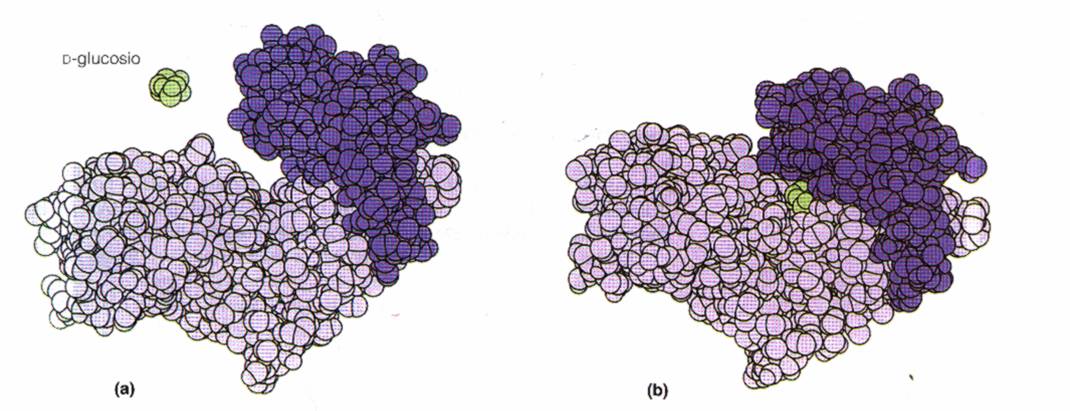
A reazione avvenuta, il prodotto viene rilasciato e l'enzima ritorna nella sua forma originaria.
Alcuni enzimi, intoltre, usano dei cofattori
che li aiutano nell'attività di catalisi. Questi cofattori
possono essere di diversa natura: metalli, gruppi eme, molecole
organiche, ecc. In genere essi sono immersi nel sito catalitico o,
comunque, in posizioni funzionali alla catalisi stessa.